7 wichtige Unterschiede in der Verwendung von Methanol und Acetonitril
Methanol und Acetonitril sind organische Lösungsmittel, die häufig als mobile Phase in der Umkehrphasenchromatographie verwendet werden. Die Eigenschaften dieser beiden organischen Lösungsmittel unterscheiden sich stark. Im Folgenden skizzieren wir 7 wichtige Unterschiede, die Sie bei der Verwendung von Methanol oder Acetonitril für die Analyse beachten sollten.
1. Säulendruck
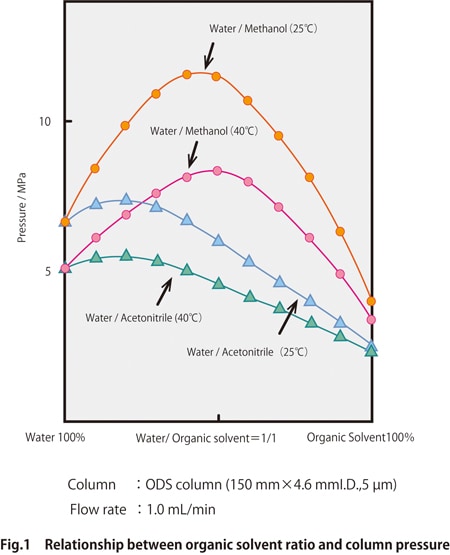
Abb. 1 zeigt ein Beispiel für das Verhältnis der Lösungsmittel sowie den Lösungsmittelabgabedruck für Mischungen aus Wasser/Acetonitril und Wasser/Methanol.
Der Druck neigt dazu, niedriger zu werden, wenn die Viskosität des Lösungsmittels aufgrund der höheren Säulentemperatur abnimmt. Wenn die Säulentemperatur zwischen 25-40 °C eingestellt wird und die Säulendrücke für Wasser/Acetonitril und Wasser/Methanol verglichen werden, können wir sehen, dass der Druck für Methanol höher ist. Beim Wechsel der mobilen Phase von Acetonitril zu Methanol sollte der Druckwiderstand des Geräts und der Säule erneut überprüft werden.
2. Absorptionsspektrum
Abb. 2 und 3 zeigen die Absorptionsspektren von Acetonitril und Methanol, einschließlich handelsüblicher Lösungsmittel für HPLC-Anwendungen und hochwertiger Lösungsmittel. Handelsübliche organische Lösungsmittel für HPLC wurden so verarbeitet, dass nahezu alle Verunreinigungen entfernt werden und die Absorption innerhalb festgelegter Grenzen zwischen bestimmten Wellenlängen liegt. Aus Abb. 2 ist ersichtlich, dass die Absorption von HPLC-Acetonitril bei kurzen Wellenlängen besonders niedrig ist. Dieses Acetonitril eignet sich daher für hochsensitive Analysen mit UV-Detektion im kurzwelligen Bereich. Darüber hinaus wurden organische Lösungsmittel, die für die LCMS-Analyse verarbeitet wurden, sowohl von UV-absorbierenden Verunreinigungen als auch von Rückständen von Metallen befreit. Dies wirkt der spezifischen Hintergrundgeräuschentwicklung bei LCMS-Analysen entgegen. Beim Wechsel des organischen Lösungsmittels von Acetonitril zu Methanol können in der Gradientenanalyse Geisterpeaks aufgrund der analytischen Bedingungen im UV-Kurzwelligen Bereich erkannt werden. In diesem Fall empfehlen wir, die Lösungsmittelqualität zu überprüfen. Wenn die Ursache der Geisterpeaks unklar bleibt und Probleme bei den Analyseergebnissen verursacht, versuchen Sie den Ghost Trap DS, der Verunreinigungen aus organischen Lösungsmitteln entfernt.
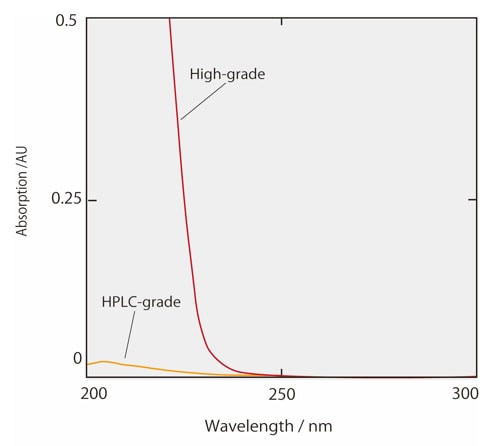
Abb. 2 Absorptionsspektrum von Acetonitril
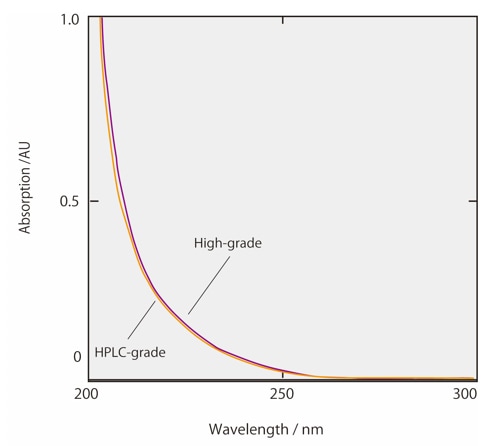
Abb. 3 Absorptionsspektrum von Methanol
3. Elutionsstärke
Abb. 4 zeigt ein Beispiel für die Trennung von Parabenen, d. h. p-Hydroxybenzoesäure, mit einer ODS-Säule. Es ist zu erkennen, dass, wenn Acetonitril und Methanol im gleichen Verhältnis mit Wasser gemischt werden, eine mobile Phase mit Acetonitril eine größere Elutionsstärke aufweist. Das Nomogramm in Abb. 5 zeigt die Verhältnisse von Methanol und Acetonitril zu Wasser mit gleichwertiger Lösungsmittelstärke, die nützlich für die ungefähre Berechnung der Elutionsstärke beim Wechsel zwischen diesen Lösungsmitteln ist. Wenn wir zuvor Acetonitril als mobile Phase mit einem Verhältnis zu Wasser von 50/50 (v/v) verwendet haben, würde das äquivalente Verhältnis von Methanol/Wasser beim Wechsel zu Methanol 60/40 (v/v) betragen.
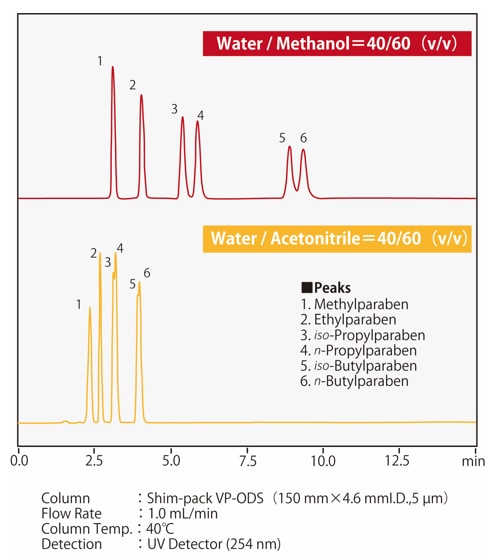
Abb. 4 Vergleich der Elutionsstärke von Methanol und Acetonitril
(p-Hydroxybenzoesäure; Parabene)
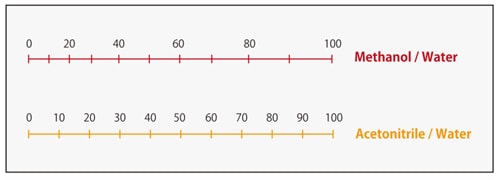
Abb. 5 Nomogramm der Lösungsmittelstärke für die Umkehrphasenchromatographie
(entnommen aus "Practical HPLC" Method Development)
4. Trennselektivität
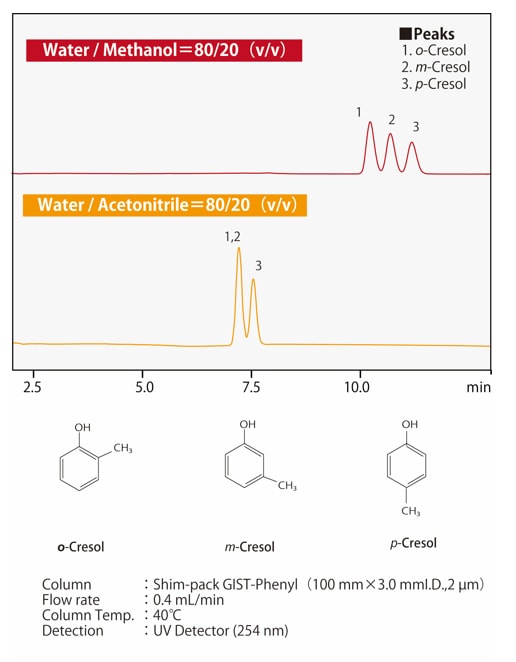 Abb. 6 Unterschied in der Selektivität zwischen Methanol und Acetonitril
Abb. 6 Unterschied in der Selektivität zwischen Methanol und Acetonitril(für posotionale Isomere von Kresol)
Die Trennselektivität von Acetonitril und Methanol unterscheidet sich. Aber da die Selektivität von den Eigenschaften der gelösten Verbindung abhängt, ist es nicht so, dass die Selektivität immer für das eine oder andere höher ist. Bei der Trennung von positionellen Isomeren können Phenylsäulen die am besten geeigneten Säulen für die Umkehrphasenchromatographie sein. Neben hydrophoben Wechselwirkungen tragen die π-π-Wechselwirkungen der phenylstationären Phase zur Trennung bei. Abb. 6 zeigt ein Beispiel für die Trennung von positionellen Isomeren von Kresol. Acetonitril (CH3-C≡N) hat eine dreifache C-N-Bindung und daher π-Elektronen, während Methanol (CH3-OH) keine π-Elektronen hat. Bei einer Phenylsäule ermöglicht die Verwendung von Methanol als mobile Phase π-π-Wechselwirkungen, was die Trennung verbessert.
5. Retentionsverhalten
Methanol und Acetonitril haben unterschiedliche chemische Eigenschaften. Methanol ist ein protisches Lösungsmittel, während Acetonitril ein nicht-protisches Lösungsmittel ist, sodass wir wissen, dass sich ihr Elutionsverhalten unterscheiden wird. Wenn mit einer acetonitrilbasierten mobilen Phase keine angemessene Trennung erzielt werden kann, ist der Wechsel zu einer methanolbasierten mobilen Phase, um die Elutionsreihenfolge zu ändern, eine nützliche Möglichkeit zur Methodenentwicklung.
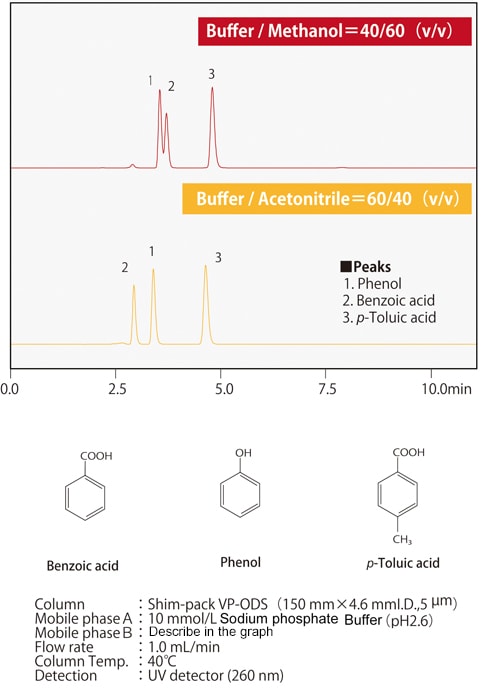 Abb. 7 Unterschiede in der Elutionsselektivität zwischen Methanol und Acetonitril
Abb. 7 Unterschiede in der Elutionsselektivität zwischen Methanol und AcetonitrilAbb. 7 zeigt ein Beispiel für die Trennung von Verbindungen durch Methanol oder Acetonitril, bei denen ein Wasserstoffatom eines Benzolrings durch eine Carboxylgruppe oder eine Hydroxylgruppe substituiert ist. Wenn die drei Verbindungen gleichmäßig reteniert werden, ist zu erkennen, dass sich die Elutionsreihenfolge von Phenol und Benzoesäure je nach verwendetem Lösungsmittel ändert. Je nach Säulentyp können zusätzlich zu den chemisch modifizierten funktionellen Gruppen wie ODS-Gruppen und C8 (Octyl)-Gruppen auch Nebenwirkungen von polaren funktionellen Gruppen aus dem Packungsmaterial auftreten. Es gibt auch Fälle, in denen die organischen Lösungsmittel und die Nebenwirkungen der funktionellen Gruppen zusammen einen positiven Effekt haben. Die Abbildungen 8 und 9 zeigen die Trennung von 13 Cephem-Antibiotika unter Verwendung einer Umkehrphasen-Säule und Acetonitril bzw. Methanol, jeweils unter denselben analytischen Bedingungen. Das Retentionsverhalten und die Elutionsreihenfolge sind unterschiedlich, je nachdem, ob Acetonitril oder Methanol verwendet wird. Wir wissen auch, dass sich die Elutionsreihenfolge je nach stationärer Phase unterscheidet. Zum Beispiel hat die C8-Säule im Vergleich zur ODS-Säule im Allgemeinen kleinere Retentionswerte. Aufgrund der polaren funktionellen Gruppen aus dem Packungsmaterial ist es jedoch nicht einfach so, dass die Retention immer kleiner ist; das Retentionsverhalten unterscheidet sich ebenfalls. Da das Retentionsverhalten von diesen verschiedenen Faktoren beeinflusst wird, ist es notwendig, verschiedene Kombinationen von mobilen und stationären Phasen auszuprobieren, um die Analysebedingungen zu optimieren.
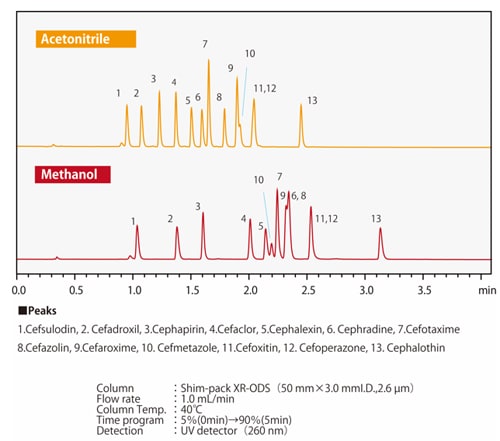
Abb. 8 Trennung von Cephem-Antibiotika unter Verwendung einer ODS-Säule
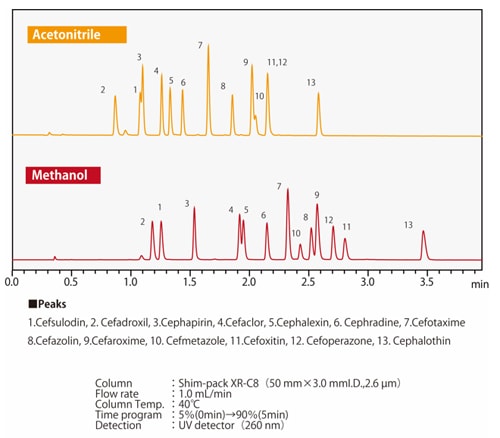
Abb. 9 Trennung von Cephem-Antibiotika unter Verwendung einer C8-Säule
6. Ausfällung durch Mischen mit einem Puffer
In der Umkehrphasenchromatographie werden Puffer mit wasserbasierten mobilen Phasen verwendet. Diese werden mit organischen Lösungsmitteln gemischt, aber je nach Art des Puffers und der organischen Lösungsmittel kann eine zu hohe Menge an organischen Lösungsmitteln dazu führen, dass das Puffersalz ausfällt. Die Tabellen 1 und 2 zeigen, ob eine Ausfällung bei Mischungen von häufig verwendeten Puffern mit Acetonitril oder Methanol auftritt. Die Werte in der Tabelle zeigen das Verhältnis (v/v), bei dem sie beginnt. Wir können sehen, dass bei einigen Puffern für keines der organischen Lösungsmittel eine Ausfällung auftritt, aber im Allgemeinen verursacht Methanol weniger davon.
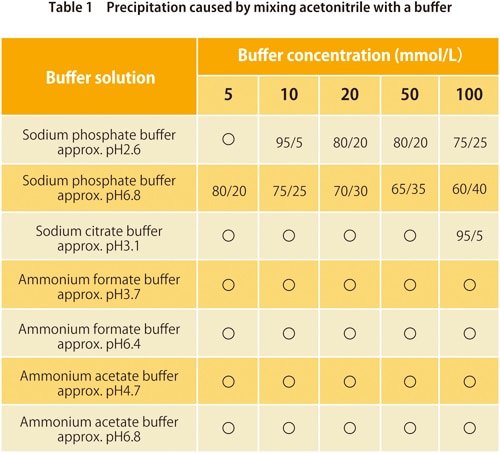
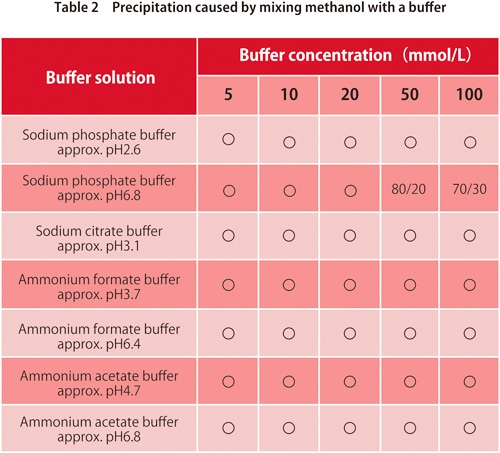
*Die in der Tabelle angezeigten Werte können je nach Laborbedingungen variieren.
** ”〇” bedeutet keine Ausfällung.
7. Reaktionswärme beim Mischen mit Wasser
Bei der isokratischen Elution werden Wasser und organisches Lösungsmittel, die im Reservoirbehälter vorvermengt sind, als mobile Phase verwendet. Beim Mischen mit Wasser reagiert Methanol exotherm. Im Gegensatz dazu reagiert Acetonitril endotherm, wodurch die Temperatur der Flüssigkeit unter Raumtemperatur sinkt. Wenn das Acetonitril-Gemisch allmählich wieder Raumtemperatur erreicht, neigen sich Blasen in der Flüssigkeit zu bilden. Außerdem, wenn das Gemisch als mobile Phase verwendet wird, bevor es wieder Raumtemperatur erreicht hat, sind die Retentionszeiten schneller und stabilisieren sich erst, wenn die Flüssigkeit sich der Raumtemperatur nähert. Inzwischen erzeugt Methanol Wärme, wenn es mit Wasser gemischt wird, was einen Entgasungseffekt hat. Das bedeutet, dass die Vorbereitung einer Wasser- und Methanolmischung als mobile Phase weniger Sorgfalt erfordert als im Fall von Acetonitril.
Zusammenfassung
Im Folgenden haben wir 7 Schlüsselpunkte vorgestellt, die bei der Wahl zwischen Methanol und Acetonitril als organisches Lösungsmittel in der HPLC-Analyse zu berücksichtigen sind. Aus der Perspektive des analytischen Workflows gibt es Unterschiede im Säulendruck, in der UV-Absorption und in der Pufferkompatibilität, und bei der analytischen Trennung sollte auf die Elutionskraft, die Trennselektivität und das Retentionsverhalten geachtet werden. Das Verständnis dieser Unterschiede in den chemischen Eigenschaften von Methanol und Acetonitril, zusammen mit geeigneten Säulenkombinationen, reduziert das Risiko von Problemen in der HPLC-Analyse und verbessert die Effizienz der Methodenentwicklung.






