pKa und Dissoziationsgleichgewicht
1. pH-Wert
Wenn Salzsäure oder eine andere Säure zu Wasser hinzugefügt wird, sinkt der pH-Wert. Die Säurekraft einer Lösung wird durch ihre Protonen-(Wasserstoffionen-)Konzentration ([H+]) bestimmt, wobei der pH-Wert einen einfachen Index zur Darstellung des [H+] Niveaus bietet. Der pH-Wert wird durch den folgenden Ausdruck angezeigt, wobei eine niedrigere Zahl eine stärkere Säure (höhere Protonenkonzentration) bedeutet.
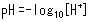
Ein wichtiger Punkt bezüglich des pH-Werts ist, dass eine Änderung von nur 1 Schritt auf der Skala einer zehnfachen Änderung der Protonenkonzentration entspricht.
Hinweis: Der Aktivitätsgrad sollte anstelle der Konzentration verwendet werden, aber die Konzentration wurde anstelle der Aktivität verwendet, da die Konzentration oft dem Aktivitätsgrad in analytischen Konzentrationen entspricht und es einfacher ist (das gleiche gilt für die folgenden Abschnitte).
2. pKa und Dissoziationsgleichgewicht
Säuren umfassen sowohl besonders starke Säuren, die sich in Wasser vollständig dissoziieren, als auch schwache Säuren, die nur teilweise dissoziieren. Wenn eine Säure dissoziiert, gibt sie ein Proton ab, um die Lösung sauer zu machen. Aber schwache Säuren haben sowohl einen dissoziierten Zustand (A-) als auch einen un dissoziierten Zustand (AH), die gemäß der folgenden Dissoziationsgleichgewichtsgleichung koexistieren:
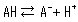
Das Konzentrationsverhältnis beider Seiten ist unter festen analytischen Bedingungen konstant und wird als Säuredissoziationskonstante (Ka) bezeichnet. Ka wird durch die folgende Gleichung definiert.
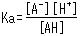
Die eckigen Klammern zeigen die Konzentration der jeweiligen Komponenten an. Basierend auf dieser Gleichung drückt Ka aus, wie leicht die Säure ein Proton abgibt (mit anderen Worten, ihre Stärke als Säure). Darüber hinaus zeigt die Gleichung, wie sich der Dissoziationszustand schwacher Säuren je nach [H+] Niveaus in der Lösung ändert.
Carbonsäuren (die -COOH enthalten), wie Essigsäure und Milchsäure, haben normalerweise eine Ka-Konstante von etwa 10-3 bis 10-6. Daher kann es unpraktisch und nicht sehr intuitiv sein, die Säurekraft nur in Bezug auf die Ka-Konstante auszudrücken.
Daher wurde pKa als Index eingeführt, um die Säurekraft schwacher Säuren auszudrücken, wobei pKa wie folgt definiert ist.
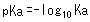
Zum Beispiel beträgt die Ka-Konstante für Essigsäure (CH3COOH) 0.0000158 (= 10-4.8), aber die pKa-Konstante beträgt 4.8, was eine einfachere Darstellung ist. Darüber hinaus gilt: Je kleiner der pKa-Wert, desto stärker die Säure. Zum Beispiel beträgt der pKa-Wert von Milchsäure etwa 3.8, was bedeutet, dass Milchsäure eine stärkere Säure als Essigsäure ist.
3. pKa und Pufferkapazität
Ein weiterer wichtiger Punkt ist die Beziehung zwischen pH und dem pKa einer Säure. Diese Beziehung wird durch die folgende Gleichung beschrieben.
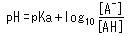
Diese Gleichung kann wie folgt umgestellt werden.
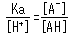
Dies zeigt, dass pKa und pH gleich sind, wenn genau die Hälfte der Säure dissoziiert ist ([A-]/[AH] = 1). Wenn sich der pH-Wert in der Nähe des pKa-Wertes um 1 ändert, ändert sich der Dissoziationsstatus der Säure in einem extrem großen Ausmaß.
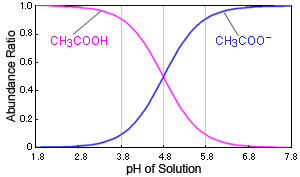
Abb. Beziehung zwischen pH der Lösung und Dissoziationsstatus der Essigsäure
Wenn sich beispielsweise der pH-Wert der Lösung in der Nähe von 4,8 ändert, bewirkt dies eine große Veränderung in der Anwesenheit von Essigsäure. Wenn der pH-Wert 3.8 beträgt, existieren über 90 % als Essigsäuremoleküle (CH3COOH), aber bei einem pH von 5.8 existieren über 90 % als Acetat-Ionen (CH3COO-).
Umgekehrt muss der Dissoziationsstatus der Säure erheblich geändert werden, um den pH-Wert in der Nähe des pKa-Wertes einer Säure zu ändern, was erfordert, dass eine extrem große Menge an Säure oder Base verwendet wird. Die Fähigkeit einer Substanz, den pH-Wert solcher Lösungen aufrechtzuerhalten, wird als ihre Pufferkapazität bezeichnet, wobei die Pufferkapazität umso höher ist, je näher pKa und pH beieinander liegen. Daher wird bei der Auswahl einer Pufferlösung, die in der Flüssigchromatographie weit verbreitet ist, eine Säure- oder Basenpufferlösung mit einem pKa-Wert, der nahe dem Ziel-pH-Wert liegt, ausgewählt, um diese Kapazität zu maximieren.






