LC & LC-MS – Konform mit der In-Vitro-Diagnostik-Verordnung (IVDR)
Shimadzu bietet Medizinprodukte für die Flüssigchromatographie und Massenspektrometrie an.

Was ist die neue EU-Verordnung über In-vitro-Diagnostika (IVDR)?
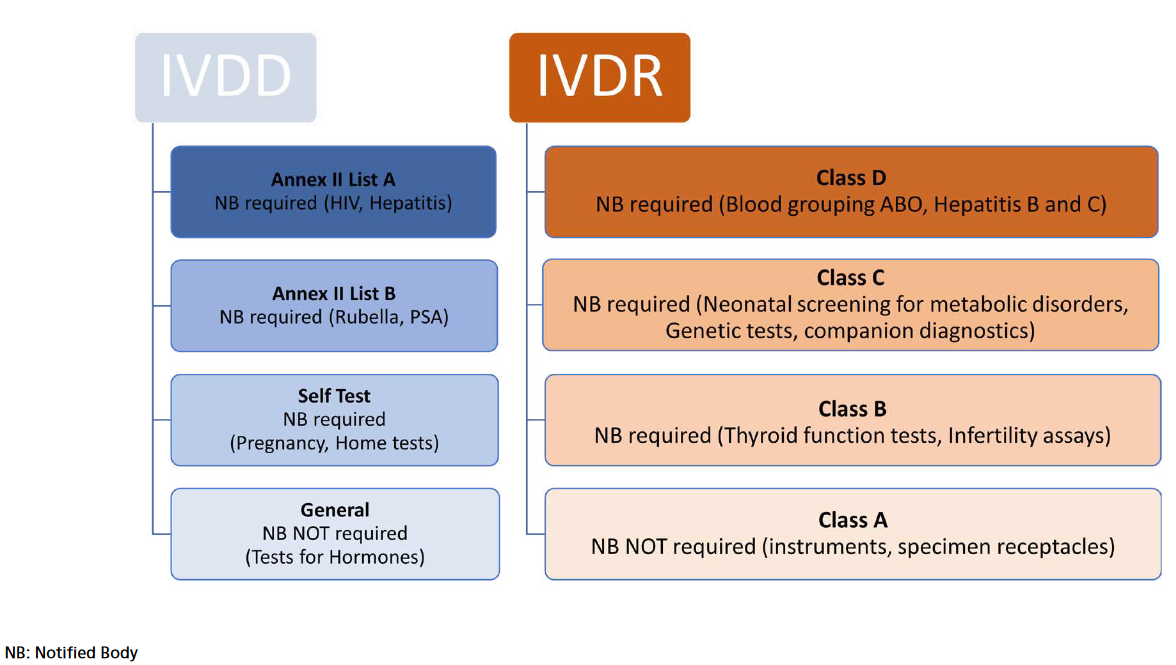
Abbildung 1. IVDR Klassifizierung
Die neue Verordnung über In-vitro-Diagnostika (IVDR) (EU) 2017/746 wurde im Mai 2017 im EU-Amtsblatt veröffentlicht, um ein hohes Maß an Sicherheit und Gesundheit zu gewährleisten und gleichzeitig Innovationen zu fördern. Sie gilt ab dem 26. Mai 2022 und ersetzt die bisherige IVD-Richtlinie (98/79/EG). Diese Verordnung enthält Vorschriften für In-vitro-Diagnostika wie Reagenzien, Kalibratoren, Kits, Instrumente und Software, die vom Hersteller für diagnostische Zwecke vorgesehen sind. Die IVDR behält einige Konzepte der IVD-Richtlinie bei, wie die CE-Kennzeichnung oder die grundlegenden Anforderungen (in der IVDR als „allgemeine Sicherheits- und Leistungsanforderungen"). Wie in der Vergangenheit müssen die Hersteller durch ein Konformitätsbewertungsverfahren nachweisen, dass sie und ihre Produkte die Anforderungen erfüllen. Anders als die IVD-Richtlinie führte die IVDR jedoch eine risikobasierte Klassifizierung ein (Abbildung 1). Nach der IVDR werden die Produkte in vier Kategorien eingeteilt: Die Produkte der Klasse A weisen ein geringes Risiko auf und umfassen Produkte für den allgemeinen Laborgebrauch sowie Zubehör, das keine kritischen Eigenschaften aufweist.
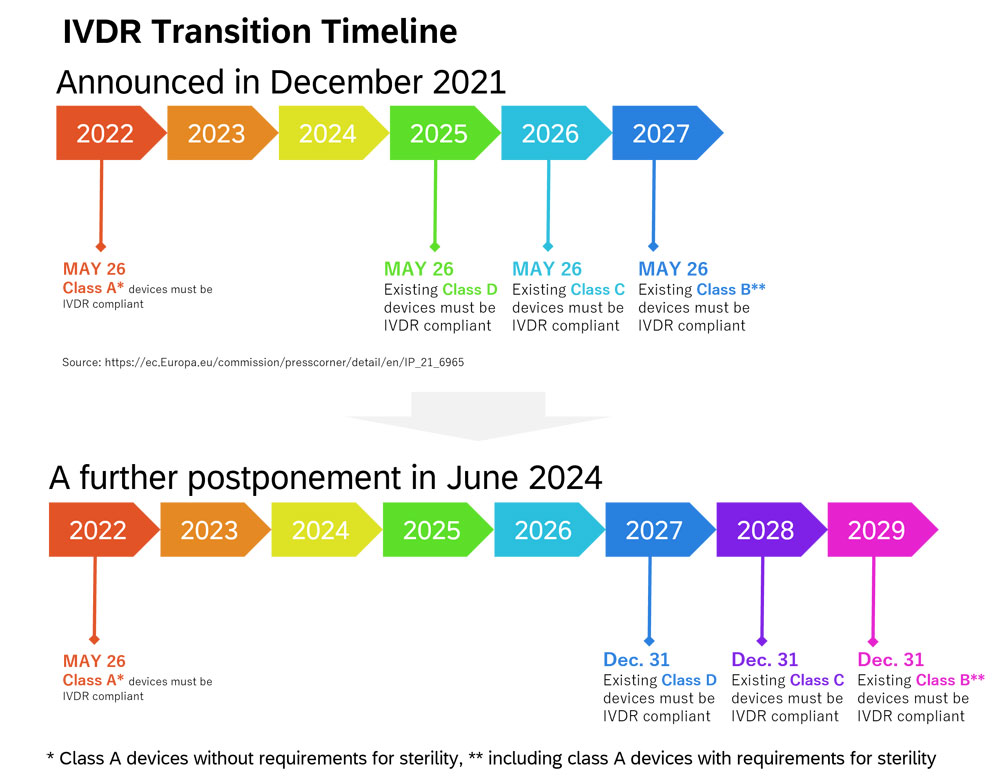
Abbildung 2. IVDR-Übergangszeitplan
Wie in Abbildung 2 dargestellt, ist für das Inverkehrbringen von Produkten der Klasse A* in der EU ab dem 26. Mai 2022 eine Selbsterklärung der Konformität durch den Hersteller erforderlich, die den Anforderungen der IVDR entspricht. Produkte der Klassen B**, C und D benötigen eine Zertifizierung durch eine akkreditierte benannte Stelle (NB), um in der EU in Verkehr gebracht werden zu können. Während unter der alten IVD-Richtlinie nur 8 % der Produkte eine Zertifizierung durch eine Benannte Stelle benötigten, sind es unter der IVDR 78 %.1 Trotzdem ist die Zahl der in der EU akkreditierten Benannten Stellen gering.2 Aus diesem Grund wurde im Dezember 2021 die Übergangsfrist je nach Klasse verschoben (Klasse B** bis 26. Mai 2027, Klasse C bis 26. Mai 2026 und Klasse D bis 26. Mai 2025). Die Europäische Kommission hat im Juni 20243 eine weitere Änderung veröffentlicht, und die Übergangsfrist für Geräte der Klasse B** wird bis zum 31. Dezember 2029, der Klasse C bis zum 31. Dezember 2028 und der Klasse D bis zum 31. Dezember 2027 verlängert.
Die CL-Serie von Shimadzu
Wird ein Research Use Only (RUO) HPLC- oder LC-MS/MS-Gerät für diagnostische Zwecke verwendet, kann es gemäß Artikel 5(5) der IVDR in ein In-house- Produkt umgewandelt werden. Der Aufwand, um die Anforderungen von Artikel 5(5) zu erfüllen, ist jedoch enorm. Daher empfehlen wir die Einführung von Produkten der IVDR-Klasse A für HPLC und LC-MS/MS, um den Arbeitsaufwand zu verringern. Shimadzu hat bereits Geräte der IVDR-Klasse A für HPLC (LC-40 CL) und LC-MS/MS (LCMS-8045/8050/8060/8060NX CL) im Jahr 2022 eingeführt. HPLC IVDR Klasse A ist ohne MS erhältlich. Jede Einheit (Pumpe, Autosampler, Ofen, Ventil und Detektor (UV)) entspricht der IVDR-Klasse A, so dass die Kombination individuell angepasst werden kann. Für LC-MS/MS kann die Serie je nach erforderlicher Empfindlichkeit ausgewählt werden.
Shimadzu hat außerdem ein Gerät der IVDR-Klasse A auf den Markt gebracht, das CLAM-2040 CL, ein vollautomatisches Probenvorbereitungsmodul für Shimadzu LC-MS/MS, das einen nahtlosen Arbeitsablauf von der aufwändigen Vorbehandlung bis zur vollautomatischen LC-MS/MS ermöglicht. Das CLAM-2040 CL ist nicht nur nahtlos, sondern auch flexibel. Je nach Anwendung können Sie ein IVDR-Klasse-A-konformes LC-MS/MS mit dem CLAM-2040 CL kombinieren. Das Design erlaubt auch die Anbindung an LIS (Laborinformationssystem) und LAS (Laborautomatisierungssystem), was eine breite Palette von Tests und Verbesserungen des Arbeitsablaufs mit LC-MS/MS ermöglicht. Es wird erwartet, dass dieses IVD-Gerät in Kombination mit handelsüblichen IVD-Kits den Anwender von dem enormen Arbeitsaufwand entlastet, der zur Erfüllung der Anforderungen von Artikel 5 Absatz 5 der IVDR erforderlich ist. Nur die Validierung durch Kombination ist noch erforderlich.
Referenzen
- MedTech Europe Survey Report, 8 September 2021.p.6-7.
medtech-europe-survey-report-analysing-the-availability-of-in-vitro-diagnostic-medical-devices-ivds-in-may-2022-when-the-new-eu-ivd-regulation-applies-8-september-2021.pdf (medtecheurope.org) - Ab dem 2. Mai 2025 gibt es nur noch 17 benannte Stellen.
EUROPA – European Commission – Growth – Regulatory policy - SMCS - Publications Office (europa.eu)
Regulation (EU) 2024/1860 of the European Parliament and of the Council of 13 June 2024 amending Regulations (EU) 2017/745 and (EU) 2017/746 as regards a gradual roll-out of Eudamed, the obligation to inform in case of interruption or discontinuation of supply, and transitional provisions for certain in vitro diagnostic medical devicesText with EEA relevance. (europa.eu) - MDCG 2023-1 Guidance on the health institution exemption under Article 5(5) of Regulation (EU) 2017/745 and Regulation (EU) 2017/746, January 2023, p.3.
mdcg_2023-1_en.pdf (europa.eu) - mdcg_2023-1_en.pdf (europa.eu)
- HYPERLINK EUR-Lex - 52024PC0043 - EN - EUR-Lex (europa.eu)
- MDCG 2022-8 Regulation (EU) 2017/746 – application of IVDR requirements to ‘legacy devices’ and to devices placed on the market prior to 26 May 2022 in accordance with Directive 98/79/EC
IVD legacy devices (europa.eu).
Neuigkeiten und Veranstaltungen
-
Willkommen zu unserem kostenlosen Onlinekurs – Troubleshooting in der Flüssigchromatographie gekoppleten Massenspektrometrie (LC-MS)
Möchten Sie Ihre Fähigkeiten in der Fehlererkennung und Fehlerbehebung im Bereich der LC-MS verbessern? Suchen Sie nach praktischen Tipps zur Prävention von Fehlern und zur effektiven Nutzung von Verbrauchsmaterialien? Dann sind Sie hier genau richtig!
Unser regelmäßig stattfindender Onlinekurs erstreckt sich über einen Zeitraum von fünf Wochen und umfasst insgesamt 6 Lerneinheiten, die Ihnen per E-Mail zugesandt werden. Wir beginnen gemeinsam mit den Grundlagen der Massenspektrometrie. Hier lernen Sie zunächst unterschiedliche Technologien und Aufnahmemodi kennen.
In den folgenden Wochen erhalten Sie wertvolle Einblicke in Maßnahmen zur Fehlerprävention und Fehlerbehebung. Wir zeigen Ihnen, wie Sie mögliche Schwierigkeiten effektiv angehen und beheben können, um eine reibungslose Durchführung Ihrer Analytik sicherzustellen. Zudem haben wir Ihnen Tipps und Tricks bei der Methodenoptimierung innerhalb der Ihrer LC-MS Analyse zusammengestellt. -
LCMS-9030 Q-TOF - Höchstleistung. Mühelos.